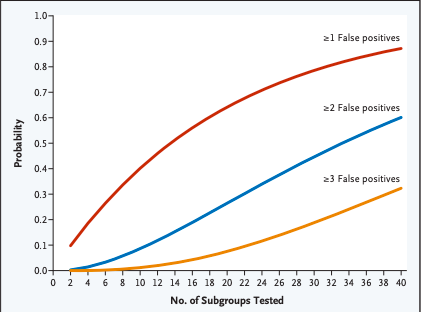
Argomento complesso, spesso ostico ma estremamente importante ai fini della pratica clinica è il focus della sessione in oggetto, ovvero il ruolo della statistica medica come aiuto e supporto al cardiologo clinico nella pratica quotidiana. La prima relazione, tenuta dal dott. Maggioni, ha trattato il topic delle analisi per sottogruppi, onnipresenti nei trials che quotidianamente leggiamo e studiamo per guidare la pratica clinica. In una analisi per sottogruppi l’interesse degli autori è verificare se caratteristiche peculiari di determinati strati del campione siano o no in grado di condizionare in modo selettivo il fenomeno che esprime l’efficacia dell’intervento. Importante è sapere, però, come interpretarle: nel classico schema riportato in ogni trial che se ne serve abbiamo in primis l’effetto dell’intervento sull’endpoint primario in tutta la casistica, seguito dall’effetto dello stesso intervento nel sottogruppo (che può essere pre-specificato nel disegno del trial oppure valutato in analisi post-hoc). La forza dell’associazione statistica è espressa dalla p per interazione, che ci dice se c’è una differenza statisticamente significativa all’interno del sottogruppo. Non sempre, però, i dati espressi sono frutto di un reale fondamento biologico, bensì del semplice “gioco” del caso che appaia i dati: a tal proposito si è espresso uno statistico, Lagakos, il quale in un brillante editoriale ha dimostrato come il numero di falsi positivi tenda ad aumentare al crescere del numero dei sottogruppi realizzati per cui egli consiglia di non considerare in assoluto il p<0.05 come soglia per la significatività statistica ma di dividere questo stesso valore per il numero dei sottogruppi considerati per cui un p<(0.05/n) sottogruppi aumenterebbe l’accuratezza della nostra analisi.
Diversi sono gli esempi di cui disponiamo in letteratura, alcuni dei quali riportati da Maggioni: nel PARAGON-HF, l’effetto di sacubitril/valsartan vs valsartan in pazienti con HFpEF è risultato neutro nella popolazione generale ma significativo in due sottogruppi: il sesso femminile e pazienti con FE > 40 e < 57%; altro esempio, il TOPCAT, anch’esso neutro nella popolazione generale ma con diverse differenze in due sottogruppi di popolazione: rischio molto più alto nella popolazione delle Americhe (31.8% di eventi) rispetto a pazienti asiatici (Russia/Georgia, 8.4% di eventi). Cosa fare in questi casi? In primis, definire se l’ipotesi in oggetto abbia, sulla base dei dati disponibili, una plausibilità biologica che possa spiegarla e, sempre da ricerche in letteratura, vedere se in altri studi siano presenti risultati analoghi. In secundis, se si ha la possibilità, disegnare un trial ad hoc. Per tali ragioni, le analisi per sottogruppi andrebbero sempre pre-specificate e definite su principi di plausibilità biologica, mentre le analisi post-hoc andrebbero sempre approcciate secondo questo schema prima di definirne la validità. Nella seconda relazione tenuta dal dott. Verdecchia si è trattato di studi di non-inferiorità. Uno studio di non-inferiorità ha l’obiettivo di dimostrare che il trattamento che stiamo valutando non è peggiore del trattamento di controllo più di una «quantità» prespecificata. Questa piccola «quantità» si chiama margine di non inferiorità, o delta; se si vuole dimostrare la non-inferiorità, il margine delta deve essere chiaramente specificato nel protocollo di studio. L’AIFA afferma che uno studio di non-inferiorità è indicato se un trattamento sia più sicuro rispetto a quello di riferimento, possa offrire dei vantaggi in termini di compliance o di costi, o ancora quando si vogliano mettere a confronto diversi dosaggi, formulazioni o vie di somministrazione di uno stesso farmaco. Come approcciarci dunque a questi studi? Innanzitutto ogni qual volta si interpretano i risultati di un trial è mandatorio capire se lo stesso sia stato disegnato come studio di superiorità o di non-inferiorità. Esempi di trial universalmente noti disegnati come studi di superiorità sono l’ISCHEMIA e il CABANA, mentre tra i maggiori studi di non-inferiorità sono menzionati i trial relativi ai DOAC (menzionato il RE-LY). Come calcoliamo il margine di non inferiorità? Per definirlo si deve tener conto di diversi elementi quali, ad esempio, il tipo di esito valutato e la sua gravità, l’efficacia degli altri trattamenti disponibili, ecc. È comunque fondamentale che il margine di non inferiorità identifichi una differenza non rilevante dal punto di vista clinico. In definitiva, ogni qual volta ci si approcci ad un trial clinico, quale che sia la rivista sulla quale è pubblicato, è sempre necessario mantenere un approccio critico e razionale allo stesso, evitando di cadere in errori provocati dalla mera casualità.



